高中化学《氨的实验室制法》
一、考题回顾
试讲题目
1.题目:氨的实验室制法
2.内容:
在实验室里,常用加热铵盐和碱的混合物的方法制取氨。由于氨易溶于水,常用向下排空气法来收集。


3.基本要求:
(1)试讲时间10分钟;
(2)教学过程中要有师生互动、课堂提问;
(3)要求配合教学内容有适当板书设计。
答辩题目
1.实验室制取氨气实验,都有哪些注意事项?
2.如何检验装置的气密性?
二、考题解析
【教学过程】
(一)导入新课
【教师提问】上节课学习了氨及氨的性质,请回顾氨都有哪些性质及其相关的化学方程式。

【教师提问】结合以往学习经验,制取氨气的实验装置一般有几部分构成?
【学生回答】发生装置、净化装置、收集装置、尾气吸收装置。
【教师提问】氨的实验室制法的发生装置是怎样的,可以采用哪种收集装置?
【学生回答】可以采用固固加热装置,由于氨气易溶于水且密度比空气小,所以可以采用向下排空气的方法收集氨气。
【教师提问】氨气是酸性还是碱性气体?收集到的氨气如何验证?
【学生回答】氨气是碱性气体,可以用湿润的红色石蕊试纸放在试管口,若湿润的红色石蕊试纸变蓝,则表示是氨气。
【多媒体展示】氨气的实验室制法简易装置。
【学生实验】学生在实验过程中,教师全程指导、答疑与纠错
【教师提问】在做实验过程中,需要注意哪些事项?
【学生小组讨论后回答】(1)组装后要对装置进行气密性检查;(2)固体药品要混合均匀,平铺试管底部;(3)试管口要略向下倾斜;(4)导出氨气的导管要短,收集氨气的导管要长,伸入试管底部;(5)试管口塞一小团棉花,防止水蒸气进入收集氨气的试管中;(6)加热时先预热再使用外焰加热。
【教师提问】现收集的氨气,是否是纯净的,如有杂质,会是哪种物质,如何除杂。
【学生回答】可能有杂质水蒸气,由于氨气是碱性气体,可以用碱石灰来除杂。
【教师提问】可以在哪个位置加上净化装置。
【学生回答】在发生装置和收集装置中间加一个净化装置。
(三)拓展提升
【教师继续提问】氨气收集满了,可以将多余的氨气直接排放到空气中?
【学生回答】不能。因为氨气有刺激性气味,排放到空气中会污染环境。可以在收集装置后添加一个尾气处理装置。因为氨气极易溶于水,可以用水来吸收;又因为氨气是碱性气体,所以可以还用酸性溶液来吸收。
(四)小结作业
【师生总结】本节课学习了氨的实验室制法有关内容,学生总结本节课的核心知识点。
【布置作业】课下思考,氮在自然界中的循环过程。
【板书设计】略
【答辩题目解析】
1.实验室制取氨气实验,都有哪些注意事项?
【参考答案】
(1)组装后要对装置进行气密性检查;
(2)固体药品要混合均匀,平铺试管底部;
(3)试管口要略向下倾斜;
(4)导出氨气的导管要短,收集氨气的导管要长并且要伸入试管底部;
(5)试管口塞一小团棉花,防止水蒸气进入收集氨气的试管中;
(6)加热时先预热再用外焰加热。
2.如何检验装置的气密性?
【参考答案】
将导管的一端放入水中,用手捂住试管一会儿,若导管口有连续的气泡冒出时,则气密性好。
高中化学《烷烃》
一、考题回顾
试讲题目
1.题目:烷烃
2.内容:
烷烃的化学性质与甲烷类似,通常较稳定,在空气中能点燃,光照下能与氯气发生取代反应。
烷烃中最简单的是甲烷,其余随碳原子数的增加,依次为乙烷、丙烷、丁烷等。碳原子数在十以内时,以甲、乙、丙、丁、戊、己、庚、辛、壬、癸依次代表碳原子数,其后加“烷”字;碳原子数在十以上,以汉字数字代表,如“十一烷”。
相邻烷烃分子在组成上均相差一个CH2原子团,如果烷烃中的碳原子数为n,烷烃中的氢原子数就是2n+2,烷烃的分子式可以用通式CnH2n+2表示。像这种结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。
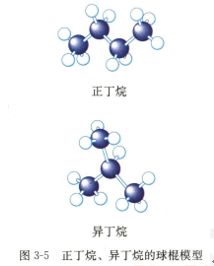
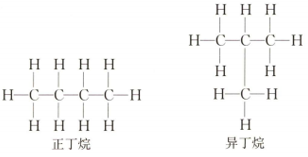
甲烷、乙烷、丙烷的结构各只有一种,而丁烷却有两种不同的结构(如图3-5所示)。虽然两种丁烷的组成相同,但分子中原子的结合顺序不同,即分子结构不同,因此它们的性质就有差异,属于两种不同的化合物。分子里碳原子相互结合形成的直链丁烷,称为正丁烷,分子里碳原子相互结合形成的带支链的丁烷,称为异丁烷。
像这种化合物具有相同的分子式,但具有不同结构的现象称为同分异构现象。具有同分异构现象的化合物互称为同分异构体。随着碳原子数的增加,烷烃的同分异构体的数目也增加。例如,戊烷有3种、己烷有5种、庚烷有9种,而癸烷则有75种之多。同分异构现象的广泛存在是造成有机物种类繁多的重要原因之一。
3.基本要求:
(1)试讲时间10分钟;
(2)教学过程中要有师生互动、课堂提问;
(3)要求配合教学内容有适当板书设计;
(4)试讲中需要用到的实验模型,用语言模拟即可。
答辩题目
1.烷烃的物理性质的递变规律是什么?
2.请问这节课的教学重难点是什么?为什么这样设置?
二、考题解析
【教学过程】
(一)温故知新导入
【提出问题】饱和烃的概念是什么?
【学生回答】碳原子之间都以碳碳单键结合成链状,剩余价键均与氢原子结合,使每个碳原子的化合价都达到“饱和”,这样的烃叫做饱和烃,也称为烷烃。
【教师引导】烷烃分子种类繁多,不同连接方式形成的分子结构不同,那这些不同结构的分子之间有怎样的关系呢?这节课一起学习“烷烃”。
(二)探究新知
【教师引导】烷烃的化学性质与甲烷类似,通常较稳定,在空气中能点燃,光照下能与氯气发生取代反应。这些相似性的烷烃分子又怎样进行命名和区分呢?
【教师讲解】烷烃中最简单的是甲烷,其余随碳原子数的增加,依次为乙烷、丙烷、丁烷等。碳原子数在十以内时,以甲、乙、丙、丁、戊、己、庚、辛、壬、癸依次代表碳原子数,其后加“烷”字;碳原子数在十以上,以汉字数字代表,如“十一烷”。
【提出问题】请说出下列烷烃的名称?
CH3(CH2)8CH3 CH3(CH2)15CH3
【学生回答】癸烷和十七烷。
【提出问题】尝试写出从甲烷到癸烷的分子式,仔细观察烷烃的分子式,看烷烃分子中C原子和H原子数目有怎样的关系?
【学生回答】学生1:相邻烷烃分子在组成上均相差一个CH2原子团。比如乙烷和甲烷相差一个CH2原子团,丙烷和甲烷相差两个CH2原子团。
学生2:如果烷烃中的碳原子数为n,烷烃中的氢原子数就是2n+2。
【教师总结】因此烷烃分子的通式为CnH2n+2。像这种结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。因为他们的结构相似,所以同系物具有相似的化学性质,物理性质不同。
【提出问题】大家知道烷烃分子就是甲烷分子中的H原子逐渐被C原子取代的过程。试着写出丙烷的结构式,当用C原子再去取代丙烷中的氢原子时,有哪些情况发生?
【学生回答】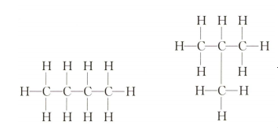
【教师引导】大家写出的分子结构式就是丁烷的结构式,丁烷中C原子取代氢原子的位置不同,导致形成的丁烷的结构不同,因此分子的性质就有差异,属于两种不同的化合物。分子里碳原子相互结合形成的直链丁烷,称为正丁烷,分子里碳原子相互结合形成的带支链的丁烷,称为异丁烷。
【展示图片】观察正丁烷和异丁烷的球棍模型也可知道,其原子的连接顺序不同,分子结构不同。
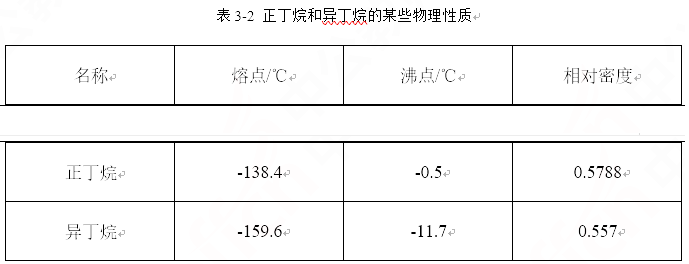
【提出问题】正丁烷和异丁烷在性质方面有哪些差异呢?结合表格3-2。归纳一下不同点。
【学生回答】由于分子的结构不同,导致正丁烷的熔沸点、密度要高于带有支链的异丁烷。
【教师总结】像这种化合物具有相同的分子式,但具有不同结构的现象称为同分异构现象。具有同分异构现象的化合物互称为同分异构体。随着碳原子数的增加,烷烃的同分异构体的数目也增加。例如,戊烷有3种、己烷有5种、庚烷有9种,而癸烷则有75种之多。同分异构现象的广泛存在是造成有机物种类繁多的重要原因之一。
(三)拓展提升
【提出问题】正丁烷和异丁烷互为同分异构体的依据是什么?
【学生回答】分子式相同,都为C4H10,但分子式内C原子的连接方式不同。
【提出问题】分析、归纳以C为骨架的有机物种类繁多的原因是什么?
【学生回答】因为碳碳之间可以形成单键、双键或三键,碳碳之间可以成环、成链,使得有机化合物存在众多种类繁多的同分异构体。
(四)小结作业
小结:学生总结归纳本节课所学主要知识,同系物和同分异构体的概念,表述学习心得。
作业:画图表示4个C原子相连接的方式有哪几种?
【板书设计】略
【答辩题目解析】
1.烷烃的物理性质的递变规律是什么?
【参考答案】
随着碳原子数的增多:
烷烃的状态由气态逐渐变为固态,一般情况下n≤4的烷烃为气态;
熔沸点由低到高;
如果碳原子数相同,支链越多,沸点越低;
烷烃的密度逐渐增大,但大多小于水。
2.请问这节课的教学重难点是什么?为什么这样设置?
【参考答案】
本节课重点是:同系物、同分异构体的概念。
难点是:区分同分异构体、同系物的概念。
同系物是指结构相似,在分子组成上相差一个或若干个CH2原子团的物质。同分异构体是分子式相同,结构不同,也就是碳原子的连接方式不同的分子。这两个概念在整个高中化学有机学习中都占有比较重要的作用,而且为后面学习炔烃、含氧衍生物等等做好了铺垫。因此本节课的重点就是要掌握这两个概念。但是在实际应用中,学生难以区分同系物和同分异构体,容易混淆、出错,因此对于这两个概念的区分成为本节课的难点。
一、考题回顾
高中化学 原电池

3.基本要求:
(1)试讲过程中要设置互动环节;
(2)试讲要讲清原理和实验。
(3)试讲时要有适当的板书设计。
二、考题解析
【教学过程】
(一)故事导入
【故事导入】阿那吉纳号漏水,探究原因。
(二)探究新知
【小组实验】把一块锌片和铜片同时插入盛有稀硫酸的烧杯中,观察实验现象(注意两块金属片不要相接触,下同)。
【学生回答】铜片:无明显变化;锌片:表面产生气泡。
【小组实验】首先将两根导线连接在一起,观察铜片表面有无变化;然后在导线中间连接一个灵敏电流计,观察电流计的指针是否发生偏转?总结结论。
【学生回答】铜片:表面有气泡产生;锌片:溶解;电流计发生指针偏转;结论:有电流产生。
【教师总结】这种将化学能转为电能的装置叫做原电池。
【提出问题】为什么会有电流产生?锌片和铜片上分别发生了什么反应,如何表示?

该装置发生了化学反应在外电路产生了电流,电子由Zn片流出,产生了电能。
【提出问题】观察两个半反应,形成原电池的条件是什么?
【学生回答】自发进行的氧化还原反应,活泼性不同的电极,电解质溶液,形成闭合回路。
【提出问题】根据原电池的工作条件,如何把一个自发进行的氧化还原反应设计成一个原电池呢?结合氧化还原反应、铜锌原电池的原理,思考正极材料、负极材料应该是选取具有氧化性还是还原性的物质。
【学生回答】
①铜锌原电池中,负极材料是锌片,发生失电子的氧化反应,说明原电池的负极材料应该是具有还原性的物质;
②铜锌原电池中,正极材料是铜片,发生得电子的氧化反应,说明原电池的正极材料应该是具有氧化性的物质。
【教师讲解】在原电池中,用还原性较强的物质作为负极,负极向外电路提供电子;用氧化性较强的物质作为正极,正极从外电路得到电子;在原电池的内部,两极浸在电解质溶液中,并通过正负离子的定性移动形成内电路。放电时,负极上的电子通过导线流向正极,再通过溶液中离子形成的内电路形成环路。(教师合铜锌原电池装置图进行讲解。)
(三)巩固提高
【提出问题】尝试解释导入故事中“阿那吉纳号”漏水的原因。
【学生回答】船体的铁与船上装载的精铜矿砂在海水作为电解质溶液的情况下形成了原电池,船体的铁作为负极被消耗,所以漏水了。
(四)小结作业
小结:师生共同总结。
作业:了解生活中常见的电池的工作原理,书写相应反应。
【板书设计】略
声明:本文真题来源考生回忆及网络渠道搜集,仅供考生参考,如有侵权,请联系删除!
下载233网校APP,可下载教师资格证面试真题!
| 免费注册233网校会员,获取教师资格证面试资料包!点击注册>> |
小编推荐:教师资格证面试考试流程 面试考生须知
真题推荐:历年教师资格证面试真题>>>
通关秘籍:教师资格证面试如何快速通关?233网校讲师将面试情景还原,助你一举攻下“结构化面试+试讲+答辩”三大内容,实战通关!免费体验>>