2019下半年高中化学教师资格证面试真题及答案第四批
高中化学《电解质》
一、考题回顾


二、考题解析
【教学过程】
环节一:实验导入
【展示实验】播放氯化钠、盐酸及酒精水溶液导电的实验,让学生观察现象。
【学生回答】氯化钠水溶液和盐酸都可以导电,而酒精的水溶液不能导电。
【提出问题】为什么会出现这种现象呢?其实这节课就来探究“电解质”。
环节二:探究新知
【提出问题】NaCl、NaOH和HCl等物质溶于水后、在水分子的作用下产生能够自由移动的水合离子,或者把NaCl、NaOH等固体加热至熔融,它们会产生自由移动的离子,那么共同特点是什么?
【学生回答】都可以导电。
【教师讲解】在水溶液或者熔融状态下能导电的化合物叫做电解质。
【提出问题】常见的电解质有哪些?
【学生回答】常见的酸、碱、大多盐。
【教师讲解】电解质在水溶液中或融融状态下产生自由移动的例子的过程称为电离。电解质的电离通常用电离方程式表示。电解质溶于水后生成水合离子,但为了书写方便,常写成简单离子的形式。
【提出问题】那硫酸、氢氧化钠和氯化钠的电离方程式如何书写?
【学生回答】H2SO4=2H++SO42-,NaOH=Na++OH-,NaCl=Na++Cl-
【提出问题】结合电离方程式发现了什么?
【学生回答】 HCl、H2SO4等酸在水溶液中都能电离出H+,而且溶液中所有的阳离子都是H+。NaOH、Ca(OH)2等碱在水溶液中都能电离出OH-,而且在溶液中所有的阴离子都是OH-。NaCl、(NH4)SO4等盐溶液中可电离出金属阳离子(或铵根离子)和酸根离子。
【提出问题】从电离的角度如何理解酸、碱?
【学生回答】从电离的角度看,酸是电离时生成的阳离子全部是H+的化合物。碱是电离时生成的阴离子全部是OH-的化合物。
【教师讲解】蔗糖、酒精等化合物,无论在水溶液还是熔融状态下均以分子形式存在,因而不能导电,这样的化合物叫做非电解质。
【提出问题】常见的非电解质有哪些?
【学生回答】葡萄糖、淀粉、油脂等有机化合物大多数是非电解质。
【提出问题】如何去区分电解质和非电解质?
【学生回答】看是否能够在水溶液或者熔融状态下导电。
环节三:拓展提升
【提出问题】下列说法错误的是( )
A.能够导电的化合物一定是电解质
B.电解质是指在水溶液或者熔融状态下能够导电的化合物
C.酸、碱、盐属于电解质
D.电解质在水溶液中存在的形式有分子和离子
【学生回答】A。能够导电的化合物不一定是电解质,如金属中的铝和铜也能够导电,但是不属于电解质。
环节四:小结作业
学生总结归纳本节课所学主要知识,表述学习心得。
作业:查找资料了解电解质的分类。
板书设计略
高中化学《明矾的净水作用》
一、考题回顾

二、考题解析
【教学过程】
环节一:实验导入
【教师演示】教师演示明矾净水的实验:取适量研磨细的明矾粉末加入到盛有河水的一个烧杯中搅拌,观察现象。

【学生回答】加入了明矾的水变得澄清了。
【教师引导】这种白色物质明矾是什么?它是如何起到净化水的作用呢?这节课我们就一起来探究“明矾的净水作用”。
环节二:探究新知
【教师讲解】明矾是一种无色的晶体,易溶于水。化学式:KAl(SO4)2·12H2O。
【提出问题】通过明矾的化学式,说明明矾由哪些粒子构成?
【学生回答】K+、Al3+、SO42—,晶体中还结合有水分子(H2O)。
【教师引导】明矾中含有两种阳离子:钾离子和铝离子,一种阴离子:硫酸根离子,像明矾这样的盐属于复盐。
【教师提问】你能尝试描述复盐的定义吗?
【学生回答】复盐是由两种或两种以上阳离子和一种阴离子组成的盐。
【媒体展示】提出问题:判断以下四种物质中属于复盐的是哪一种?
①硫酸亚铁铵:(NH4)2Fe(SO4)2·6H2O
②偏铝酸钠:NaAlO2
③硫酸铁钾:KFe(SO4)2·12H2O
④碱式碳酸铜:Cu2(OH)2CO3
【学生回答】学生1.③;学生2.①③;学生3.②③等等。
【教师总结引导】属于复盐的是①③
①硫酸亚铁铵俗名为莫尔盐,含有两种阳离子:铵根离子和亚铁离子,一种阴离子硫酸根离子,所以属于复盐;
②偏铝酸钠是由阳离子钠离子和阴离子偏铝酸根离子构成的,只有一种阳离子钠离子,铝元素是以偏铝酸根的形式存在于阴离子中,不属于复盐;
③硫酸铁钾中含有两种阳离子:钾离子和铁离子,一种阴离子硫酸根离子,属于复盐;
④碱式碳酸铜只含有一种阳离子铜离子,两种阴离子,不属于复盐。
【提出问题】结合复盐的概念,书写明矾溶于水发生电离的方程式,其他学生在纸上书写。
【学生板书】KAl(SO4)2=K++Al3++2SO42-
【教师引导】明矾是一种常见的净水剂,之前我们在学习胶体的时候有了解一种具有净水作用的物质——氢氧化铁[Fe(OH)3]胶体。
【提出问题】氢氧化铁胶体是如何起到净水作用的?利用了胶体的哪种性质?
【学生回答】利用了胶体的吸附性,氢氧化铁胶体通过吸附水中的悬浮颗粒,沉降后达到净水目的。
【教师引导】明矾净水的实质与氢氧化铁胶体净水实质是相同的。尝试推断明矾净水的实质和原理是什么?
【合作探究】明矾溶于水后电离出的铝离子进一步与水反应,即铝离子发生水解,生成了氢氧化铝[Al(OH)3]胶体,Al(OH)3胶体具有很强的吸附能力,它能凝聚水中的悬浮物并使之沉降,从而达到净水的目的。
【媒体展示】多媒体播放视频:150倍速下,河水中的悬浮物在Al(OH)3胶体作用下的沉降过程,学生直观感受、加深认知。

【教师引导】注意胶体不是沉淀,不能在Al(OH)3后面写沉淀符号“↓”。
环节三:拓展提升
【教师引导】已知明矾的净水原理,可以利用这些知识解决日常生活中的很多问题。接下来分小组讨论如下两个问题:
①明矾净水的实质是什么?
②明矾作为净水剂,能够对水进行杀菌消毒吗?
【小组讨论,教师总结】
①明矾净水的实质是氢氧化铝胶体的吸附性。
②明矾不具有强氧化性,所以只能净化水但不能对水起到杀菌消毒的作用。
环节四:小结作业
请学生畅谈收获,体会收获与成功的喜悦。
作业:课下查阅资料,生活中还有哪些净水剂、其净水的原理是什么。
板书设计略
高中化学《离子反应及其发生的条件》
一、考题回顾
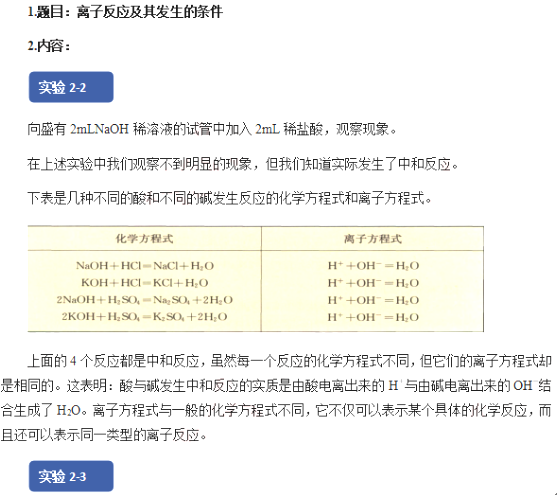
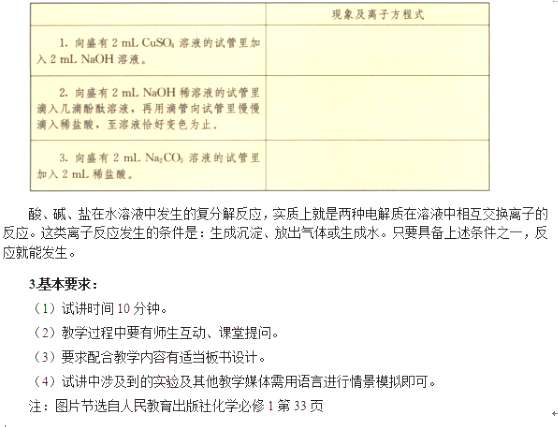
二、考题解析
【教学过程】
环节一:生活导入
【提出问题】根据我们上节课的学习,离子方程式如何书写?
【学生回答】“写、拆、删、查”。
【提出问题】哪些条件下可以发生离子反应?
【学生回答】在生成难溶物时可以发生,例如Na2SO4与BaCl2反应生成BaSO4沉淀。
【教师引导】今天我们就来探究还有哪些条件可以发生离子反应。
环节二:探究新知
【提出问题】根据之前所学及预习,猜想有哪些条件可以发生离子反应?
【学生回答】除难溶物之外还有水、气体参与反应或生成的条件下可发生离子反应。。
【教师引导】那今天我们就通过两组实验来探究有水、气体参与反应或生成的条件下是否能发生离子反应?
实验1:向盛有2mLNaOH溶液的试管中先滴加两滴酚酞,再滴加稀HCl,观察现象并思考原因?
【学生回答】溶液由红色变为无色,NaOH与HCl发生了离子反应生成了水。
【教师总结】NaOH电离出Na+和OH-,OH-使溶液显碱性,滴加酚酞指示剂后变红,滴加稀盐酸OH-和H+发生中和反应,即H++OH-=H2O,溶液又褪色,OH-和H+数目减少,Na+和C1-数目没有发生变化。说明在有水生成的条件下可以发生离子反应,离子反应式为:H++OH-=H2O。
【教师引导】我们通过实验已经证明了在有难溶物、水参与的条件下可以发生离子反应,有气体参与的反应又该如何验证呢?
【学生回答】用Na2CO3和HCl反应生成CO2来验证。
【学生操作】实验2:向盛有2mLNa2CO3溶液的试管中加入2mLHCl溶液。
【描述现象】溶液中有气泡产生,发生了离子反应。
【教师总结】Na2CO3电离出Na+和CO32-,滴加稀盐酸后CO32-和H+反应生成H2O和CO2,即
CO32-+H+=H2O+CO2↑,CO32-和H+数目减少,Na+和Cl-数目没有发生变化。
【教师总结】酸、碱、盐在水溶液中发生的复分解反应,实质上就是两种电解质在溶液中相互交换离子的反应。这类离子反应发生的条件是:生成沉淀、放出气体或生成水。只要具备上述条件之一,反应就能发生。
环节三:拓展提升
【媒体展示】已知离子反应发生的条件是:生成沉淀、放出气体或生成水,那接下来大家来判断多媒体上的着几组物质能否发生离子反应?(PPT)。
【学生回答】1.NaOH与H2SO4(可以)
2.NaCl与H2SO4(不可以)
3.AgNO3与NaCl(可以)
(四)小结作业
学生总结归纳本节课所学主要知识,表述学习心得。
作业:课下总结酸、碱、盐发生的离子反应方程式。
板书设计略
下载233网校APP,可方便及时获取高中化学教师资格证面试真题。

真题推荐:历年教师资格证面试真题>>>
教师资格证面试如何快速通关?233网校还原面试情景现场,助你一举攻下“结构化面试+试讲+答辩”三大内容,实战通关!试听课程>>
答疑解惑:添加小编微信个人号【ks233wx3】,或关注微信公众号【jiaoshi_233】搜索微信公众号“233网校教师资格证考试”,关注即可一对一答疑解惑!

